zulandri11; Sistem Periodik Unsur adalah kelanjutab dari Materi Struktur Atom. siswa tidak akan mengetahui apa yang dimaksud dengan Sistem Periodik sebelum mempelajari Struktur Atom. Nah, pada pembahasan kali ini akan dikupas secara tuntas tentang Sistem Periodik Unsur. Mulai dari Perkembangan Sistem Periodik, Sifat Logam, hingga Sifat- Sifat Sistem Periodik.
A. PERKEMBANGAN SISTEM PERIODIK
Usaha pengelompokan unsur-unsur berdasarkan kesamaan sifat dilakukan agar unsur-unsur tersebut mudah dipelajari.
1. Triade Dobereiner
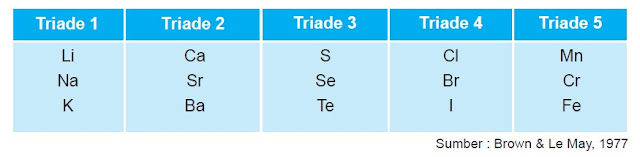
Pada tahun 1829, Johan Wolfgang Dobereiner mempelajari sifat-sifat beberapa unsur yang sudah diketahui pada saat itu. Dobereiner melihat adanya kemiripan sifat di antara beberapa unsur, lalu mengelompokkan unsur-unsur tersebut menurut kemiripan sifatnya. Ternyata tiap kelompok terdiri dari tiga unsur sehingga disebut triade. Apabila unsur-unsur dalam satu triade disusun berdasarkan kesamaan sifatnya dan diurutkan massa atomnya, maka unsur kedua merupakan rata-rata dari sifat dan massa atom dari unsur pertama dan ketiga.
 |
| Sistem Periodik Unsur |
A. PERKEMBANGAN SISTEM PERIODIK
Usaha pengelompokan unsur-unsur berdasarkan kesamaan sifat dilakukan agar unsur-unsur tersebut mudah dipelajari.
1. Triade Dobereiner
Pada tahun 1829, Johan Wolfgang Dobereiner mempelajari sifat-sifat beberapa unsur yang sudah diketahui pada saat itu. Dobereiner melihat adanya kemiripan sifat di antara beberapa unsur, lalu mengelompokkan unsur-unsur tersebut menurut kemiripan sifatnya. Ternyata tiap kelompok terdiri dari tiga unsur sehingga disebut triade. Apabila unsur-unsur dalam satu triade disusun berdasarkan kesamaan sifatnya dan diurutkan massa atomnya, maka unsur kedua merupakan rata-rata dari sifat dan massa atom dari unsur pertama dan ketiga.
Tabel Daftar Unsur Triade Dobereiner
2. Teori Oktaf Newland
Pada tahun 1864, John Alexander Reina Newland menyusun daftar unsur yang
jumlahnya lebih banyak. Susunan Newland menunjukkan bahwa apabila
unsur-unsur disusun berdasarkan kenaikan massa atomnya, maka unsur
pertama mempunyai kemiripan sifat dengan unsur kedelapan, unsur kedua
sifatnya mirip dengan unsur kesembilan, dan seterusnya. Penemuan Newland
ini dinyatakan sebagai Hukum Oktaf Newland.
Tabel Daftar Unsur Oktaf Newland
Pada saat daftar Oktaf Newland disusun, unsur-unsur gas mulia (He, Ne,
Ar, Kr, Xe, dan Rn) belum ditemukan. Gas Mulia ditemukan oleh Rayleigh
dan Ramsay pada tahun 1894. Unsur gas mulia yang pertama ditemukan ialah
gas argon. Hukum Oktaf Newland hanya berlaku untuk unsur-unsur dengan
massa atom yang rendah.
3. Sistem Periodik Mendeleev
Pada tahun 1869, tabel sistem periodik mulai disusun. Tabel sistem
periodik ini merupakan hasil karya dua ilmuwan, Dmitri Ivanovich
Mendeleev dari Rusia dan Julius Lothar Meyer dari Jerman. Mereka
berkarya secara terpisah dan menghasilkan tabel yang serupa pada waktu
yang hampir bersamaan. Mendeleev menyajikan hasil kerjanya pada Himpunan
Kimia Rusia pada awal tahun 1869, dan tabel periodic Meyer baru muncul
pada bulan Desember 1869.
Mendeleev yang pertama kali mengemukakan tabel sistem periodik, maka ia
dianggap sebagai penemu tabel sistem periodik yang sering disebut juga
sebagai sistem periodik unsur pendek. Sistem periodik Mendeleev disusun
berdasarkan kenaikan massa atom dan kemiripan sifat. Sistem periodik
Mendeleev pertama kali diterbitkan dalam jurnal ilmiah Annalen der
Chemie pada tahun 1871.
Tabel Sistem Periodik Unsur Mendeleev pada tahun 1871
dalam satu golongan mempunyai sifat yang mirip. Hal penting yang
terdapat dalam sistem periodik Mendeleev antara lain sebagai berikut:
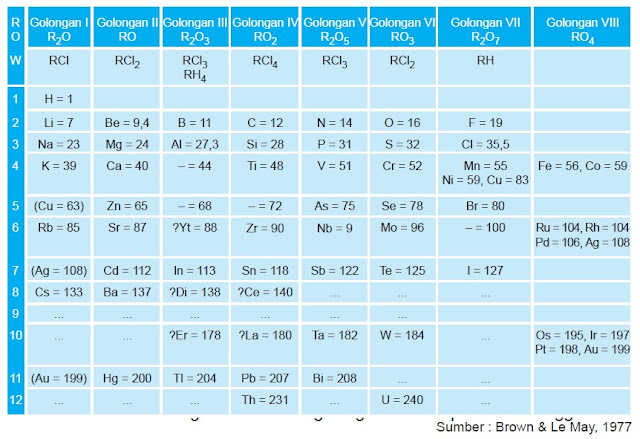
- dua unsur yang berdekatan, massa atom relatifnya mempunyai selisih paling kurang dua atau satu satuan;
- terdapat kotak kosong untuk unsur yang belum ditemukan, seperti 44, 68, 72, dan 100;
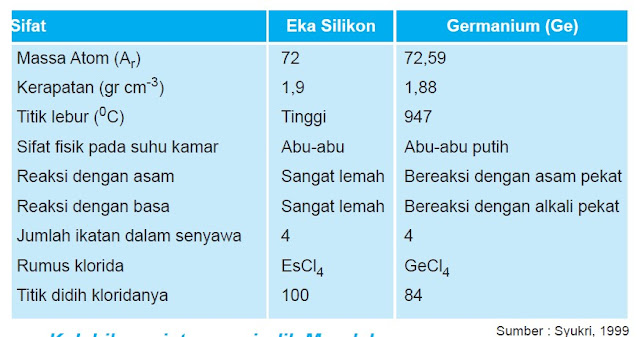
- dapat meramalkan sifat unsur yang belum dikenal seperti ekasilikon;
- dapat mengoreksi kesalahan pengukuran massa atom relatif beberapa unsur, contohnya Cr = 52,0 bukan 43,3.
Tabel Sifat Eka-Silikon yang diramal oleh Mendeleev (1871) dibandingkan Germanium (1886)
a. Kelebihan sistem periodik Mendeleev
- Sifat kimia dan fisika unsur dalam satu golongan mirip dan berubah secara teratur.
- Valensi tertinggi suatu unsur sama dengan nomor golongannya.
- Dapat meramalkan sifat unsur yang belum ditemukan pada saat itu dan telah mempunyai tempat yang kosong.
b. Kekurangan sistem periodik Mendeleev
- Panjang periode tidak sama dan sebabnya tidak dijelaskan.
- Beberapa unsur tidak disusun berdasarkan kenaikan massa atomnya, contoh : Te (128) sebelum I (127).
- Selisih massa unsur yang berurutan tidak selalu 2, tetapi berkisar antara 1 dan 4 sehingga sukar meramalkan massa unsur yang belum diketahui secara tepat.
- Valensi unsur yang lebih dari satu sulit diramalkan dari golongannya.
- Anomali (penyimpangan) unsur hidrogen dari unsur yang lain tidak dijelaskan.
4. Sistem Periodik Modern
Pada tahun 1914, Henry G. J. Moseley menemukan bahwa urutan unsur dalam
tabel periodik sesuai dengan kenaikan nomor atom unsur. Moseley berhasil
menemukan kesalahan dalam tabel periodik Mendeleev, yaitu ada unsur
yang terbalik letaknya. Penempatan Telurium dan Iodin yang tidak sesuai
dengan kenaikan massa atom relatifnya, ternyata sesuai dengan kenaikan
nomor atom. Telurium mempunyai nomor atom 52 dan iodin mempunyai nomor
atom 53. Sistem periodik modern bisa dikatakan sebagai penyempurnaan
sistem periodik Mendeleev.
Sistem periodik modern dikenal juga sebagai sistem periodik bentuk
panjang, disusun berdasarkan kenaikan nomor atom dan kemiripan sifat.
Dalam sistem periodic modern terdapat lajur mendatar yang disebut
periode dan lajur tegak yang disebut golongan (lihat lampiran).
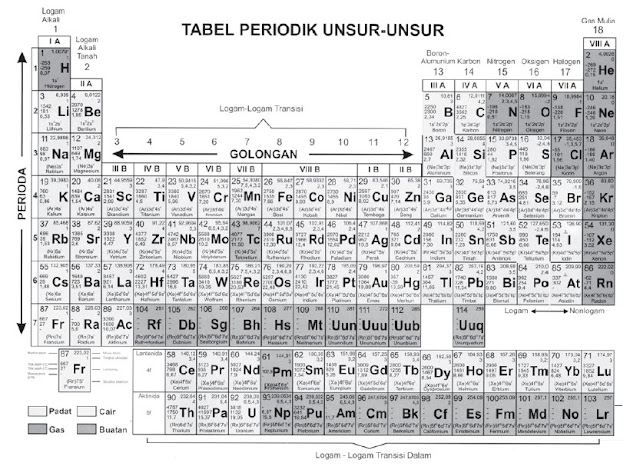 |
Gambar Tabel sistem periodik modern |
Jumlah periode dalam sistem periodik ada 7 dan diberi tanda dengan angka:
- Periode 1 disebut sebagai periode sangat pendek dan berisi 2 unsur
- Periode 2 disebut sebagai periode pendek dan berisi 8 unsur
- Periode 3 disebut sebagai periode pendek dan berisi 8 unsur
- Periode 4 disebut sebagai periode panjang dan berisi 18 unsur
- Periode 5 disebut sebagai periode panjang dan berisi 18 unsur
- Periode 6 disebut sebagai periode sangat panjang dan berisi 32 unsur, pada periode ini terdapat unsur Lantanida yaitu unsur nomor 58 sampai nomor 71 dan diletakkan pada bagian bawah
- Periode 7 disebut sebagai periode belum lengkap karena mungkin akan bertambah lagi jumlah unsur yang menempatinya, sampai saat ini berisi 24 unsur. Pada periode ini terdapat deretan unsur yang disebut Aktinida, yaitu unsur bernomor 90 sampai nomor 103 dan diletakkan pada bagian bawah.
Jumlah golongan dalam sistem periodik ada 8 dan ditandai dengan angka
Romawi. Ada dua golongan besar, yaitu golongan A (golongan utama) dan
golongan B (golongan transisi). Golongan B terletak antara golongan IIA
dan golongan IIIA.
Nama-nama golongan pada unsur golongan A
• Golongan IA disebut golongan alkali
• Golongan IIA disebut golongan alkali tanah
• Golongan IIIA disebut golonga boron
• Golongan IVA disebut golongan karbon
• Golongan VA disebut golongan nitrogen
• Golongan VIA disebut golongan oksigen
• Golongan VIIA disebut golongan halogen
• Golongan VIIIA disebut golongan gas mulia
Pada periode 6 golongan IIIB terdapat 14 unsur yang sangat mirip
sifatnya, yaitu unsur-unsur lantanida. Pada periode 7 juga berlaku hal
yang sama dan disebut unsur-unsur aktinida. Kedua seri unsur ini disebut
unsur-unsur transisi dalam. Unsur-unsur lantanida dan aktinida termasuk
golongan IIIB, dimasukkan dalam satu golongan karena mempunyai sifat
yang sangat mirip.
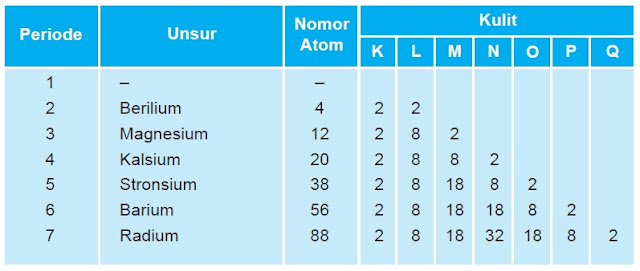
5. Hubungan konfigurasi elektron dengan sistem periodic
Perhatikanlah konfigurasi elektron golongan IA dan IIA berikut:
Golongan IA
Golongan IIA
Dari konfigurasi elektron dua golongan unsur di atas, dapat dilihat
hubungan antara konfigurasi elektron dengan letak unsur (nomor periode
dan golongan) dalam sistem periodik sebagai berikut:
Hal yang sama berlaku untuk semua golongan utama (golongan A), kecuali
Helium (He) yang terletak pada golongan VIIIA tetapi mempunyai elektron
valensi 2. Adapun untuk unsur-unsur golongan transisi (golongan B) tidak
demikian halnya. Jumlah kulit memang sama dengan nomor periode, tetapi
jumlah elektron valensi (elektron terluar) tidak sama dengan nomor
golongan. Unsur-unsur golongan transisi mempunyai 1 atau 2 elektron
valensi
B. SIFAT LOGAM
Sifat yang dimiliki oleh unsur sangat banyak. Pada Kata Kunci bahasan
ini, kita hanya akan membahas beberapa sifat dari unsur. Berdasarkan
sifat kelogamannya, secara umum unsur dibedakan menjadi tiga kategori,
yaitu unsur logam, unsur non logam, dan unsur metalloid (semi logam).
Logam banyak kita jumpai di sekitar kita, contohnya besi, aluminium,
tembaga, perak, emas, dan lain-lain. Pada umumnya logam mempunyai sifat
fisis, antara lain:
1. penghantar panas yang baik;
2. penghantar listrik yang baik;
3. permukaan logam mengkilap;
4. dapat ditempa menjadi lempeng tipis;
5. dapat meregang jika ditarik.
Kemampuan logam untuk meregang apabila ditarik disebut duktilitas.
Kemampuan logam meregang dan menghantarkan listrik dimanfaatkan untuk
membuat kawat atau kabel. Kemampuan logam berubah bentuk jika ditempa
disebut maleabilitas. Kemampuan logam berubah bentuk jika ditempa
dimanfaatka untuk membuat berbagai macam jenis barang, misalnya golok,
pisau, cangkul, dan lain-lain. Sifat-sifat di atas tidak dimiliki oleh
unsur-unsur bukan logam (non logam).
Jika dilihat dari konfigurasi elektronnya, unsur-unsur logam cenderung
melepaskan elektron (memiliki energi ionisasi yang kecil), sedangkan
unsur-unsur non logam cenderung menangkap elektron (memiliki energi
ionisasi yang besar). Dengan demikian, dapat dilihat kecenderungan sifat
logam dalam sistem periodik, yaitu dalam satu golongan dari atas ke
bawah semakin besar dan dalam satu periode dari kiri ke kanan semakin
kecil. Jika kita lihat pada tabel periodik unsurnya, unsurunsur logam
berletak pada bagian kiri, sedangkan unsur-unsur non logam terletak di
bagian kanan (lihat tabel periodik unsur).
Pada tabel periodik, batas antara unsur-unsur logam dan non logam sering
digambarkan dengan tangga diagonal yang bergaris tebal. Unsur-unsur di
daerah perbatasan mempunyai sifat ganda. Misalnya logam berilium (Be)
dan aluminium (Al), logam-logam tersebut memiliki beberapa sifat bukan
logam, dan biasa disebut unsur amfoter. Adapun logam yang berada di
sebelahnya (dalam tabel periodik) yaitu Boron (B) dan Silikon (Si)
merupakan unsur non logam yang memilki beberapa sifat logam, dan disebut
unsur metaloid.
C. SIFAT-SIFAT SISTEM PERIODIK
Sistem periodik unsur disusun dengan memperhatikan sifat-sifat unsur.
Sifat-sifat periodik unsur adalah sifat-sifat yang berubah secara
beraturan sesuai dengan kenaikan nomor atom unsur. Sifatsifat periodik
unsur yang kita bahas meliputi jari-jari atom, energi ionisasi, afinitas
elektron, dan keelektronegatifan.
1. Jari-Jari Atom
Jari-jari atom adalah jarak dari inti atom sampai kulit elektron terluar
yang ditempati elektron. Panjang pendeknya jari-jari atom tergantung
pada jumlah kulit elektron dan muatan inti atom. Makin banyak jumlah
kulit elektron maka jari-jari atom semakin panjang, dan bila jumlah
kulit atom sama banyak maka yang berpengaruh terhadap panjangnya
jari-jari atom ialah muatan inti. Semakin banyak muatan inti atom, makin
besar gaya tarik inti atom terhadap elektronnya sehingga elektron lebih
dekat ke inti. Jadi, semakin banyak muatan inti, maka semakin pendek
jari-jari atomnya.
Unsur-unsur yang segolongan, dari atas ke bawah memiliki jari-jari atom
yang semakin besar karena jumlah kulit yang dimiliki atom semakin
banyak. Unsur-unsur yang seperiode, dari kiri ke kanan jari-jari atomnya
semakin kecil. Hal itu disebabkan unsur-unsur yang seperiode dari kiri
ke kanan memiliki jumlah kulit yang sama tetapi muatan intinya semakin
besar.
2. Energi ionisasi
Energi ionisasi adalah energi minimum yang diperlukan atom untuk
melepaskan satu elektron yang terikat paling lemah dari suatu atom atau
ion dalam wujud gas. Harga energi ionisasi dipengaruhi oleh besarnya
nomor atom dan ukuran jari-jari atom. Makin besar jari-jari atom, maka
gaya tarik inti terhadap elektron terluar makin lemah. Hal itu berarti
elektron terluar akan lebih mudah lepas, sehingga energi yang diperlukan
untuk melepaskan elektron terluar makin kecil.
Energi ionisasi pertama digunakan oleh suatu atom untuk melepaskan
electron kulit terluar, sedangkan energi ionisasi kedua digunakan oleh
suatu ion (ion +) untuk melepaskan elektronnya yang terikat paling
lemah. Untuk mengetahui kecenderungan energi ionisasi unsur-unsur dalam
system periodik dapat dilihat pada daftar energi ionisasi pertama
unsur-unsur dalam system periodik yang harganya sudah dibulatkan.
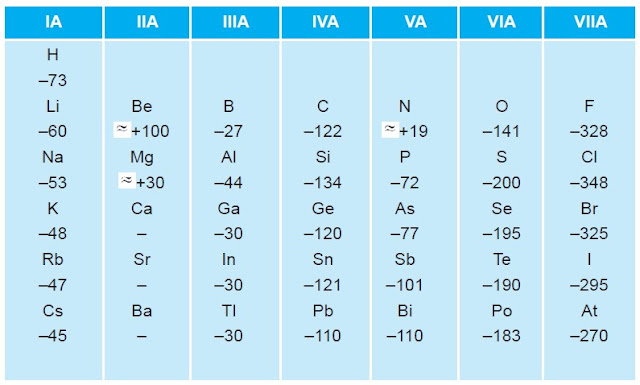
3. Afinitas Electron
Afinitas elektron adalah besarnya energi yang dihasilkan atau dilepaskan
oleh atom netral dalam bentuk gas untuk menangkap satu elektron
sehingga membentuk ion negatif.
Afinitas elektron dapat digunakan sebagai ukuran mudah tidaknya suatu
atom menangkap elektron. Afinitas elektron dapat benilai negatif atau
positif. Afinitas elektron bernilai negatif apabila terjadi pelepasan
energi pada saat menangkap elektron. Sebaliknya, afinitas elektron
berharga positif apabila terjadi penyerapan energi pada saat menangkap
elektron. Semakin besar energi yang dilepas (afinitas elektron negatif),
semakin besar kecenderungan untuk mengikat elektron menjadi ion
negatif. Untuk lebih memahami hal tersebut, perhatikan tabel berikut.
Tabel Afinitas elektron unsur representative
Dari Tabel di atas dapat dilihat bahwa untuk golongan alkali tanah (IIA)
dan gas mulia (VIIIA) afinitas elektronnya semuanya berharga positif.
Hal tersebut menunjukkan bahwa unsur-unsur golongan IIA dan VIIIA sukar
menerima elektron. Afinitas electron terbesar ialah golongan halogen
(VIIA). Artinya, unsur-unsur golongan VIIA paling mudah menangkap
elektron dan terbentuk ion negatif yang stabil.
Dari data-data tersebut, dapat disimpulkan bahwa afinitas elektron
unsur-unsur dalam satu golongan dari atas ke bawah semakin kecil,
sedangkan unsur-unsur dalam satu periode dari kiri ke kanan semakin
besar.
4. Keelektronegatifan
Keelektronegatifan adalah kecenderungan suatu atom dalam menarik
pasangan elektron yang digunakan bersama dalam membentuk ikatan. Semakin
besar harga keelektronegatifan suatu atom, maka semakin mudah menarik
pasangan elektron untuk membentuk ikatan, atau gaya tarik elektronnya
makin kuat. Keelektronegatifan unsur ditentukan oleh muatan inti dan
jari-jari atomnya.
Nilai mutlak keelektronegatifan tidak dapat diukur, tetapi nilai
relatifnya dapat dicari seperti dengan cara Pauling. Menurut Pauling,
keelektronegatifan unsur gas mulia adalah nol. Artinya, gas mulia tidak
mempunyai kemampuan untuk menarik elektron. Pauling menetapkan unsur
Fluor (F) sebagai standard. Berdasarkan hal tersebut, dihitung nilai
untuk unsur yang lain. Untuk melihat nilai-nilai keelektronegatifan
unsur-unsur, perhatikan gambar berikut.
Dari gambar tersebut, dapat disimpulkan bahwa keelektronegatifan
unsur-unsur dalam satu golongan dari atas ke bawah semakin kecil,
sedangkan unsur-unsur dalam satu periode dari kiri ke kanan semakin
besar.
















0 comments:
Post a Comment